学習資料
文書
- 博士論文
-
Structural analysis of polymer aggregation induced by hydrophilic and hydrophobic interaction
(親水性・疎水性相互作用に起因する高分子の凝集構造についての研究 )
光散乱法、中性子散乱法、ミクロ相分離の理論などを、なるべく省略なしに詳述しました。 - 非線形感受率の導出
-
CARSの実験を始めるにあたって、コロナ禍で実験ができなくなったため、 家で一度手を動かしたノートをまとめたものです。
非線形感受率の他に、CARSとテンソルに関する計算も少し加えています。
1章がとてもあっさりなので、分光研究の記事などでの予習が必要かと思います。 - Laser-assisted electron scattering
-
助教時代に行っていた強光子場下における電子線散乱の理論を、 なるべく少ない予備知識で理解できるようにまとめたものです。
とてもマニアックですが、何かの役に立てば。 - 第14回 光塾 講演資料(抜粋)
-
講演予定の内容の内、公表できるような真面目な部分を抜粋したものです。
時間の関係上、一部を飛ばして説明したましたが、資料としては公開しておきます。 - 電子メールの書き方の基本
-
電子メールを打ったことがない大学生が増えてきたので…ということで以前使用したスライドを改訂しました。
私が最初に電子メールを打ったのはいつだろうか…
スライドにはないですが、早稲田の研究室ではSlackを使っていて、これはビジネス版のLINEみたいな感じです。 - 滴定曲線を例としたpHの計算
-
芝浦工大での基礎化学の授業の補助教材として使用してきた資料ですが、
当面授業で使わなさそうだったので、公開します。
分析化学における近似の考え方を理解できるようにしたつもりです。
最後の「考えてみよう・調べてみよう」は、シンプルに私の体力不足です。 - 赤外吸収スペクトルと分子振動
-
芝浦工大での化学分光学の授業の補助教材として使用してきた資料です。
「アセトンのCO伸縮振動」という表現は近似的なもので、そこそこ他の結合も動いているよ、という説明をしていました。
赤外吸収スペクトルは、 有機化合物のスペクトルデータベース(SDBS)を参照しています。
誤植があれば適宜ご連絡ください。
博士論文はもう直せませんが、その他は修正します。
実験
実験を進める上で役に立ちそうなことをまとめていきます。
マイクロピペットの使い方
メーカーが様々な使い方動画を出しているので、使用前に一度見てみてください。
「1段階押して吸って、2段階押して吐くだけ」という理解はやや不十分だということに気づくと思います。
以下、最低限の知識をまとめます。
-
マイクロピペットは、主に水溶液を調製するときに使います。
といっても、有機溶媒に対して使うことも可能です。
その際は、チップ(基本的にポリプロピレン)の耐薬品性や、
溶媒揮発に伴うピペット内部の汚染が影響ないかについて調べるようにしてください。
不安ならパスツールピペットで秤量して定量するのが無難です。 -
私はよく「ピペットマン」と言いますが、「ピペットマン」はGilson社のマイクロピペットの製品名です。
「宅急便」がヤマト運輸の宅配便サービスの名称なのと同じです。
当研究室にあるマイクロピペットは、P100だけピペットマンです。 -
まずは適切なマイクロピペットを選ぶことから始めます。
以下の表を参考に、測りたい容量に対応するマイクロピペットを選んでください。
例えば40 μLを測るときは、P200を使ってもいいですが、
P100を使ったり、P20を2回使ったりした方が精度は少し良くなります。
ただ、この選定より、正しい使い方で分取する方が重要です。 -
次に、ダイヤルを回してマイクロピペットの分取量を設定します。
当研究室のマイクロピペットは、1, 10, 100 μLの位が黒字で、それ以外の位は赤字です。
読み方を間違えると桁違いの量の分取になるので、気をつけてください。
また、分取量の設定時には、一度大きめの容量までダイヤルを回してから戻すようにしてください。
目標値に下から合わせるのと上から合わせるのとでは、
ギアの遊びの関係で若干容量が異なるようです。
例えば50 μLに合わせるときは、最初に51 μLくらいまで回してから50 μLに戻すようにしてください。
なお、ダイヤルはロックすることもできますが、
同じ量で大量に計り取るとき以外はロックは不要だと思います。
-
マイクロピペットに、対応するチップをつけます。
チップホルダーに入っているチップに対して、マイクロピペットを垂直に下げて挿入します。
小気味良くマイクロピペットをトントンしがちですが、精密機器なので避けましょう。
また、ほこりが入るのを避けるために、チップホルダーのふたは早めに閉めるようにしてください。 -
マイクロピペットのプッシュボタンを1段階目まで押してから、
チップの先端を溶液の内部に入れて、プッシュボタンをゆっくり離すことによって分取します。
チップ先端は、液面よりちょっと(数cm)下くらいにします。
先端を容器の底まで突っ込むと、水圧によって少し多めにチップに流入してしまいます。
また、プッシュボタンを一気に離すと、低粘度液体ではマイクロピペット本体に液体が噴出してしまうことがあります。
ゆっくり吸って、落ち着いてからゆっくりチップを引き上げるようにしましょう。 -
溶液を吸うときは、マイクロピペットを垂直にしましょう。
垂直からずれると、1 %程度のオーダーですが、所定量からずれます。
-
液体を排出するときは、マイクロピペットのプッシュボタンを1段階目までゆっくり押します。
どのくらいゆっくりかというと、液体がチップに引きずられて残らないくらいです。
希薄な水溶液の場合は、そこまで気を付けなくてもきれいに出せます。
基本的には1段階目まで押したら全ての液体が出ます。
その上で、プッシュボタンを2段階目まで押して完了します。
流派によっては1段階目までしか押し込まないこともあります。
希薄な水溶液の場合は、そこまで気を付けなくてもきれいに出せますが、
プッシュボタンを一気に1段階目まで押し込むと、
排出速度に追いつけずにチップ内に残った液体が、
壁面を伝って少しずつ溜まってくることがあります(つまり、正確に排出できていない)。
また、液体が溜まっている状態でプッシュボタンを離すと、
液体が内部まで吸い込まれて出せなくなることもあるので注意しましょう。 -
高粘度液体の場合でも、プッシュボタンをゆっくり離せば原理上は取ることができます。
ただ、排出するときにチップに残らずきれいに出し切れないのであれば、
マイクロピペットを使わずに、スパチュラ+天秤で重量を基に測る方が良いです。 -
個人的な趣味もありますが、
液体をスクリュー管から採取する時は、
蓋とスクリュー管を片手で両方持つと、
蓋を机につけず、なおかつ芸術点の高い操作になります。
また、状況によりますが、液体排出時に両手が使えるならば、
利き手でマイクロピペットのプッシュボタンを操作しながら、
反対の手でマイクロピペットを指で止めると、
チップが震えずに安定した操作ができます。 -
場合によっては、複数の溶液を混合する場合もあります。
代表的な例は、溶液の希釈です。
希釈の基本は、少量の原液を先に取って、
その後に希釈用の溶媒(大抵は水)を入れるという流れになります。
そして、溶媒を加える際はプッシュボタンを1段階目まで押して排出し、
その後にチップの先端を溶液につけた状態でプッシュボタンを離します。
次に、吸い込んだ溶液をプッシュボタン1段階押しで排出し、
またチップの先端を溶液につけてプッシュボタンを離します。
これを10回程度行うことによって、
溶液をしっかりと混合することができます。
ピペッティングと呼ばれる、とても大事な操作です。
ピペッティング時は気泡を入れないように、
プッシュボタンを1段階目までで止めるのがポイントです。
混合が完了したら、チップの先端を溶液から離した上で、
プッシュボタンを2段階目まで押して完了します。 -
普通のチップは大した値段では無いので(1本1円くらい)、
使い回しなどせずに捨てましょう。
(フィルター付きのちょっと良いチップもこの世にはあります。)
同じ溶液を複数回取るときや、
純水を複数の容器に分けるときなどはチップを使いまわしても良いですが、
計り取る溶液以外の何かにチップの先端が触れた場合には容赦無く捨ててください。
チップを手で外す人もいますが、
通常のマイクロピペットにはチップを外す用のトリガーが付いています。 -
チップ入れが空になったら、チップを補充します。
当研究室では無菌条件が必要になるような実験はしていないので、
手袋をしてチップをストックから直接出しても良いのですが、
何かの弾みでストック全体を汚すと困るので、
一度アルミホイル上にチップを出してから、
手袋をして、ちまちまチップ入れにチップを補充するようにしています。
| 呼び名 | 使用可能容量 | チップの種類 | 使用推奨容量 |
|---|---|---|---|
| P1000 | 100–1000 μL | 青 | 200–1000 μL |
| P200 | 20–200 μL | 黄 | 50–200 μL |
| P100 | 10–100 μL | 黄 | 20–100 μL |
| P20 | 2–20 μL | 黄 | 2–20 μL |
| P2 | 0.1–2 μL | 透明 | 0.2–2 μL |

マイクロピペットの容量は頭に書いてある。
各容量での値の読み取り例を示した。
有効数字も含めてしっかり理解しておくこと。

見栄え良く液体を取る方法。
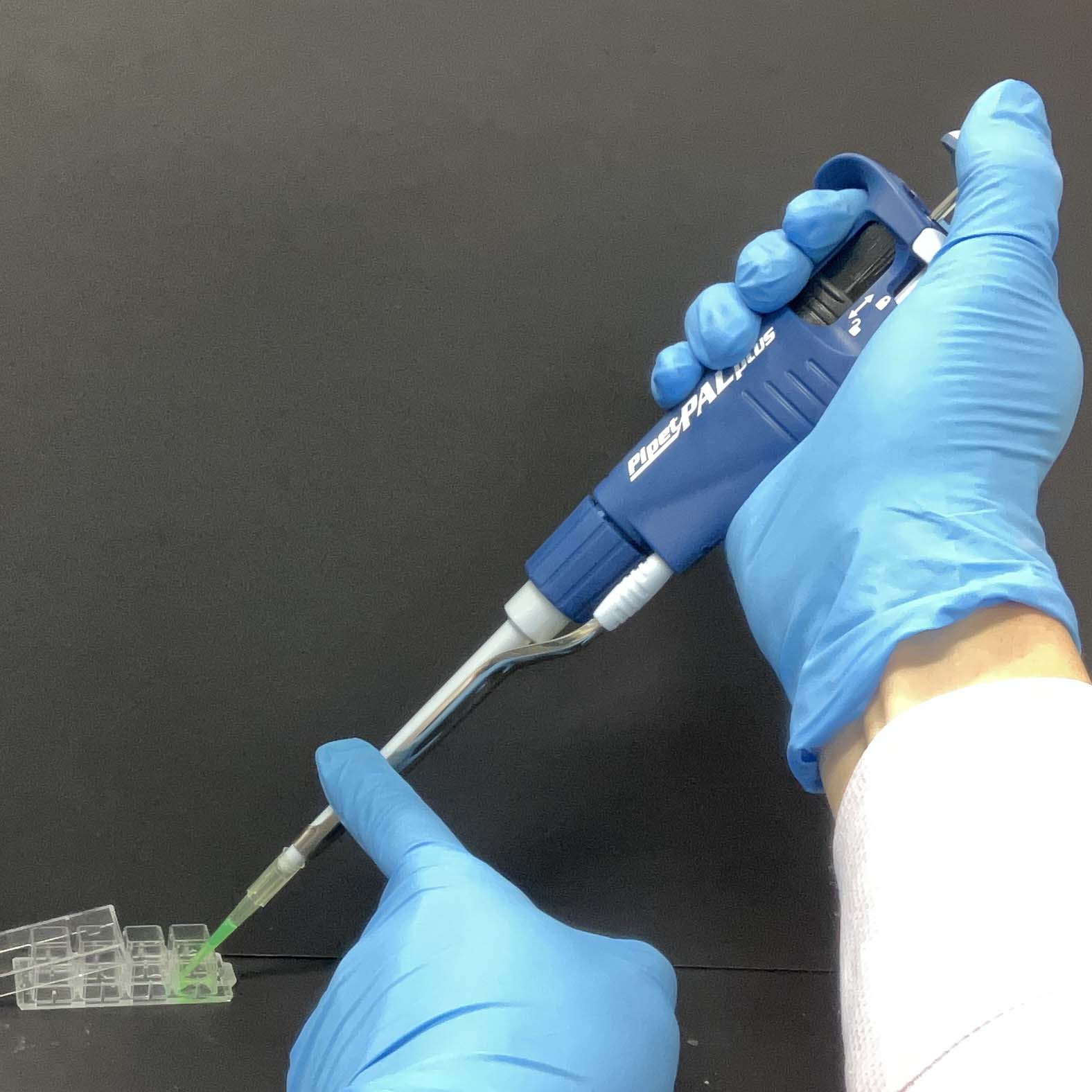
震えず液体を分注する方法。
マイクロメーターの読み方
光学素子の位置を精密に調整するときは、可動ステージをマイクロメーターによって動かします。
私の研究室で使っている標準的なマイクロメーターは、1回転すると0.50 mm動きます。
1回転するごとに、主軸に振られている目盛りと可動部の左端が一致します。
最小単位は0.01 mm = 10 μmです。
一般的な可動ステージで干渉計を組むと、干渉縞はそこそこ揺らいでいましたが見えていたので、
普通の定盤でおとなしく使えば、0.1 μmくらいの安定度はあるのかなと思っています。
慣れるまでは読みにくいと思うので、慣れましょう。
以下の写真で読みをマスターしてください。
パソコンでご覧の方は、マウスを押しているときだけ拡大されます。
















3Dプリンターの活用
ちょっとした治具や容器が欲しいときに、3Dプリンターを使っています。
何かのアイディアになれば、ということで作品集を公開します。
いずれも大したものではないですが、あるとちょっと便利だったり片付いたりします。
キャビネットの仕切り板
記念すべき第一号は、ただの板です。
光学素子類はキャビネットにまとめているのですが、
キャビネットの引き出し一つ一つが大きすぎるので、
板で仕切ることにしました。
最初はプラダン(段ボール風プラスチック)で作ることも考えたのですが、
強度が弱い&断面を見るのが苦手ということで、3Dプリンターで作りました。
チョークケース
授業は板書スタイルとしていますが、異なる色のチョークを教室に運ぶためのケースを作りました。
5本入りで、ケースがちょうどシャツの胸ポケットに入るサイズになっています。
ロッド立て
よく取り外すロッドを定盤上に立てて置く用のホルダーです。
ホルダーを光学定盤に固定できるようにして、安定化させています。
これでレンズを光学定盤上に寝転がすみたいなことはなくなります。
ロッドは直径12 mmと12.7 mmがよく出てくるので、
直径12.7 mmでもスッと入るように余裕を持った穴径にしましょう(1敗)。
スマホホルダーのホルダー
撮影用にスマホホルダーを用意したのですが、
よくあるスマホホルダーは薄い机に挟んで固定するタイプです。
光学定盤は厚すぎるので、光学定盤上に挟めるようにするホルダーを作りました。
これでスマホを固定して、音声やスマートウオッチで遠隔で撮影できるようにすれば、
快適な動画作成ライフが送れます。
アルミフレーム固定用L字治具
光学定盤の遮光用に、黒い板で定盤を囲うことを検討しました。
遮光板を光学定盤のサイズに合わせて手できれいに切り出すのは難しそうだったので、
規格品のB4サイズの
ポスターボード(7 mm厚)をアルムフレームに差し込む形にしました。
ただ、アルミフレームを自由に光学定盤に立てるには、
ちょうどよいL字金具がありませんでした。
L字アングルから自分で切って穴を空ければ作れますが、
そんなに強度がいるわけでもないということで、
3Dプリンターで作ってみました。
長孔にすることによって、位置調整に遊びを持たせています。
L字の角から長孔までの長さを15, 20, 25, 30 mmの4種類にすることによって、
25 mm間隔の光学定盤上でどこに置いても固定できるようにしています。
L字の角は孔を邪魔しない程度に厚くして、折れにくくしています。
スクリュー管立て
6 mL(ラボランのNo.2)のスクリュー管をよく使います。
これで安全に持ち運びしやすくなります。
木っぽい色にしたのは趣味です。
他のサイズでも作りました。
角セル立て
上述のスクリュー管立てと同じサイズで、一般的な角セル立ても作りました。
通常の光路長10 mmの角セルのサイズは12.5 mm角ですが、
先に作ったスクリュー管立ての短辺の長さが26 mmで、ギリギリ2列にできなかったので、
苦し紛れに交互にずらしながら詰められるだけ詰めるようにしています。
スクリュー管や角セルは、
手持ちのケースに雑多に入れていたのですが、
この手持ちのケースにぴったり収納できるようにしました。
パスツールピペット置き
上述のスクリュー管立てと同じ横幅で、パスツールピペット置きを作りました。
これは、高校生向け実験教室で6種類の溶液を測り取る際にミスがないように、
6本のパスツールピペットを順番に置くことを意識しています。
なお、駒込ピペットも置けますが、
ゴム首のサイズの関係で6本は置けなくなります。
短辺はスクリュー管立ての2/3としており、
手持ちのケースに芸術点高く収納できるようにしました。
映像
- 動的光散乱法の原理
-
数式なしで動的光散乱について解説した動画です。
数式を含めた詳細は書籍「相関分光法」などを参照してください。 - CARSおよび動的ラマン散乱法の原理
-
数式なしでCARSおよび動的ラマン散乱について解説した動画です。
第18回分子科学討論会の招待講演用に作ったアニメーションをベースにしています。 - NMRにおける外部磁場と共鳴周波数の関係
-
NMRの基本原理の講義の補助資料として作成した動画です。
現代のNMRでは、磁場強度をスキャンすることはありませんが、
低磁場側・高磁場側という表現は名残で残っています。
通常は、磁場強度の代わりに、入射する電磁波(ラジオ波)を変化させています。
電磁波の波長についても、実際はスキャンせず、様々な波長を一度に照射して、
その後に解析(Fourier変換)によって波長成分ごとの応答を算出します。 - 1次元ランダムウォークの変化
-
高分子1本鎖の構造の講義の補助資料として作成した動画です。
Rubinstein and ColbyのPolymer Physicsをベースに講義をしています。
1次元ランダムウォークの厳密解を棒グラフで、
歩数が増えると成り立つGauss近似の解を青線で示しています。
なお、1次元ランダムウォークは偶奇によって飛び飛びになることから、
動画内の青線は規格化された関数の2倍の大きさで描かれています。 - 高分子の相分離の熱力学
-
高分子の相分離の講義の補助資料として作成した動画です。
重合度が同じ、異なる高分子の混合について(NA = NB = 150, χT = 5)、
温度を変えたときの内部エネルギーU, エントロピーS、およびHelmholtzの自由エネルギーFの変化を示し、
Fの1次微分、2次微分を計算することによって、BinodalとSpinodalを視覚的に表しています。
なお、重合度が異なる場合(高分子溶液を含む)についてはBinodalの計算が煩雑で断念しております… - 数独を解く大腸菌の作り方
-
2010年にiGEM UTokyoのメンバーとして作成した動画です。